Kontrol
Termodinamik dan Kontrol Kinetik Senyawa Organik
Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic =
'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses.
Termodinamika berhubungan dekat dengan mekanika statistik di mana banyak hubungan termodinamika berasal.
Pada sistem di mana terjadi proses
perubahan wujud atau pertukaran energi, termodinamika klasik tidak berhubungan
dengan kinetika reaksi (kecepatan suatu
proses reaksi berlangsung). Karena alasan ini, penggunaan istilah
"termodinamika" biasanya merujuk pada termodinamika setimbang. Dengan
hubungan ini, konsep utama dalam termodinamika adalah proses kuasistatik, yang diidealkan,
proses "super pelan". Proses termodinamika bergantung-waktu
dipelajari dalam termodinamika
tak-setimbang.
Karena termodinamika tidak berhubungan dengan konsep waktu, telah diusulkan bahwa termodinamika
setimbang seharusnya dinamakan termostatik.
Konsep dasar dalam termodinamika
Pengabstrakkan dasar atas termodinamika
adalah pembagian dunia menjadi sistem dibatasi oleh kenyataan atau ideal dari
batasan. Sistem yang tidak termasuk dalam pertimbangan digolongkan sebagai
lingkungan. Dan pembagian sistem menjadi subsistem masih mungkin terjadi, atau
membentuk beberapa sistem menjadi sistem yang lebih besar. Biasanya sistem
dapat diberikan keadaan yang dirinci dengan jelas yang dapat diuraikan menjadi
beberapa parameter. Dari prinsip-prinsip dasar termodinamika secara umum bisa
diturunkan hubungan antara kuantitas misalnya, koefisien ekspansi,
kompresibilitas, panas jenis, transformasi panas dan koefisien elektrik,
terutama sifat-sifat yang dipengaruhi temperatur.
Sistem termodinamika
Sistem termodinamika adalah bagian
dari jagat raya yang diperhitungkan. Sebuah batasan yang nyata atau imajinasi
memisahkan sistem dengan jagat raya, yang disebut lingkungan. Klasifikasi
sistem termodinamika berdasarkan pada sifat batas sistem-lingkungan dan
perpindahan materi, kalor dan entropi antara sistem dan lingkungan.
Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara
sistem dan lingkungan:
- sistem terisolasi: tak terjadi
pertukaran panas, benda atau kerja dengan lingkungan. Contoh dari sistem
terisolasi adalah wadah terisolasi, seperti tabung gas terisolasi.
- sistem tertutup: terjadi
pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran benda
dengan lingkungan. Rumah
hijau adalah
contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi tidak
terjadi pertukaran kerja dengan lingkungan. Apakah suatu sistem terjadi
pertukaran panas, kerja atau keduanya biasanya
dipertimbangkanh sebagai sifat pembatasnya:
- pembatas adiabatik: tidak
memperbolehkan pertukaran panas.
- pembatas rigid:
tidak memperbolehkan pertukaran kerja.
- sistem terbuka: terjadi
pertukaran energi (panas dan kerja) dan benda dengan lingkungannya. Sebuah
pembatas memperbolehkan pertukaran benda disebut permeabel. Samudra merupakan contoh dari
sistem terbuka.
Dalam kenyataan, sebuah sistem tidak dapat terisolasi sepenuhnya dari
lingkungan, karena pasti ada terjadi sedikit pencampuran, meskipun hanya
penerimaan sedikit penarikan gravitasi. Dalam analisis sistem
terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari
sistem.
Pengertian kinetik dan
termodinamik enolat
Senyawa karbonil yang memiliki H alfa jika diperlakukan pada kondisi asam,
akan
membentuk enol, sedangkan pada kondisi
basa membentuk ion enolat. Kondisi asam 3
termasuk kontrol termodinamik karena mengacu pada
kestabilan intermediet (enol).
Sedangkan kondisi basa, termasuk kontrol kinetik
karena mengacu pada terbentuknya
ion enolat yang berjalan cepat.
Perlakuan metil keton dengan LDA biasanya menghasilkan
hanya lithium enolat pada
sisi metil. Enolat ini terbentuk cepat, dan berikutnya
dikenal dengan nama enolat
kinetik. Alasan terbentuk cepat:
a. proton pada gugus metil adalah lebih asam
b. terdapat tiga H alfa pada sisi metil dibandingkan 2
H alfa pada sisi lainnya
c. terdapat hambatan sterik pada penyerangan LDA pada
sisi lain dari gugus karbonil.
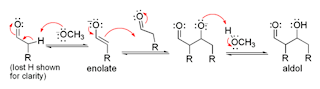
Mekanisme enolat
Dalam reaksi kondensasi ini apabila digunakan katalis basa moderat seperti
ion hidroksida atau alkoksida, maka reaksi aldol terjadi melalui serangan
nukleofil oleh stabilitas resonansi ion enolat pada gugus karbonil. Produk
aldol adalah garam alkoksida, kemudian terbentuk aldol itu sendiri. Setelah itu
mengalami dehidrasi membentuk senyawa karbonil tidak jenuh. Mekanisme
selengkapnya dapat dilihat pada gambar 5.
Tahap 1. Mekanisme aldol
terkatalis basa
Tahap 2. Dehidrasi
Gambar 5. Mekanisme enolat
Kontrol termodinamika dan
kinetika dari enolat
Apabila keton asimetrik direaksikan dalam kondisi basa, hal ini berpotensi
ke bentuk dua regioisomer enolat (mengabaikan geometri enolar), dapat dilihat
pada gambar 12. Adanya enolat trisubstitusi mengarah pada kinetika dari enolat,
sedangkan enolat tetrasubstitusi mengarah ke termodinamika dari enolat.
Hidrogen α terdeprotonasi untuk membentuk enolat kinetika adalah kurang
menghambat, oleh karena deprotonasi lebih cepat. Secara umum olefin
tetrasubstitusi lebih stabil dari pada olefin trisubstitusi oleh adanya
stabilisasi hiperkonjugasi. Rasio regioisomer ini dipengaruhi oleh pilihan
basa.
Gambar 12. Produk
termodinamika dan kinetika
Pada contoh reaksi tersebut kontrol kinetika dapat dilakukan dengan menggunakan
LDA pada suhu -78 °C, hal ini akan memberikan perbandingan kinetika :
termodinamika sebesar 99 : 1. Sedangkan kontrol termodinamika dapat dilakukan
dengan trifenil metil litium pada suhu kamar, akan memberikan selektivitas 10 :
90.
Secara umum, kinetika dari enolat dilakukan dengan cara reaksi dilakukan
pada kondisi dingin, hal ini akan terjadi ikatan ionik antar logam–oksigen dan
deprotonasi berlangsung cepat dalam kondisi yang lebih ringan. Sedangkan
termodinamika dari enolat terjadi pada temperatur yang lebih tinggi dan terjadi
ikatan kovalen logam–oksigen. Waktu kesetimbangan lebih longgar pada
deprotonasi dengan sejumlah sub-stoikiometrik dari basa kuat. Penggunaan
sejumlah sub-stoikiometrik basa memungkinkan dihasilkan sejumlah kecil fraksi
senyawa karbonil tak–terenolasi untuk menyeimbangkan enolat ke regioisomer
termodinamika dengan bertindak sebagai sumber proton.
.png)
.png)
Tidak ada komentar:
Posting Komentar