Gugus pergi dan pengeruh gugus tetangga
Organik Fisis : Partisipasi Gugus Tetangga
partisipasi gugus tetangga didefinisikan sebagai gugus
yang memberikan suatu reaksi intermediate yang baru pada pusat reaksi. Untuk
reaksi substitusi seperti dibawah, X sebagai gugus tetangga berperan dalam
penyerangan nukleofilik intramolekul sehingga melepaskan Y sebagai gugus pergi,
yang kemudian diikuti oleh substitusi intermolekul.
Hasil dari partisipasi ini ialah pembentukan produk
substitusi dengan konfigurasi yang berlawanan dengan konfigurasi yang
seharusnya terjadi pada SN2, dimana reaksi SN2 pada umumnya membentuk
konfigurasi yang berlawanan dengan substrat. Dengan adanya partisipasi gugus
tetangga, konfigurasi produk sama dengan substrat.
Partisipasi gugus tetangga ini juga dapat mempengaruhi
kecepatan reaksi. Jika suatu gugus tetangga mempengaruhi reaksi melalui suatu
jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga
tersebut dikatakan sebagai “anchimeric assistance”. Peningkatan kecepatan
reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan
laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama
pada senyawa analog yang tidak memiliki gugus tetangga.
Gugus tetangga dapat menggunakan pasangan elektronnya
untuk berinteraksi dengan sisi belakang atom karbon yang menjalani substitusi,
sehingga mencegah serangan dari nukleofilik, sehingga nukleofilik hanya dapat
bereaksi dengan atom karbon dari sisi depan, dan produknya mengikuti konfigurasi
awal.
Atom atau gugus yang dapat meningkatkan laju SN2
melalui partisipasi gugus tetangga ialah nitrogen dalam bentuk amina, oksigen
dalam bentuk karboksilat dan ion alkoksida, dan cincin aromatik. Partisipasi
hanya efektif jika interaksinya membentuk cincin segitiga, lima dan enam.
Ø PARTISIPASI
OKSIGEN SEBAGAI GUGUS TETANGGA
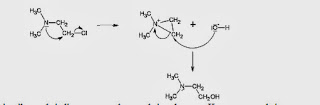
Contoh partisipasi oksigen ialah pada substitusi basa
dari 1,2-klorohidrin menghasilkan 1,2-diol dengan konfigurasi yang tidak
berubah.
Serangan awal dilakukan oleh basa pada pembentukan
anion alkoksida, dilanjutkan dengan serangan internal oleh RO- dan menghasilkan
epoksida dengan inversi konfigurasi pada C*. Atom karbon ini selanjutnya
menjalani reaksi SN2 oleh serangan OH-, dengan inversi konfigurasi yang kedua
pada C*. Anion alkoksida yang kedua ini mengabstraksi proton dari pelarut untuk
membentuk produk 1,2-diol dengan konfigurasi yang sama dengan substrat.
Contoh lain dari partisipasi oksigen sebagai gugus tetangga ialah pada
hidrolisis anion 2-bromopropanoat dengan konsentrasi OH- yang rendah, juga
diperoleh hasil dengan konfigurasi yang tidak berubah. Kecepatan reaksi tidak
bergantung dari konsentrasi OH-, dan mekanismenya ialah :
Ø PARTISIPASI
NITROGEN SEBAGAI GUGUS TETANGGA
Partisipasi nitrogen sebagai gugus tetangga dapat
terjadi dalam bentuk aminanya, seperti reaksi substitusi senyawa amina di bawah
ini :
kinetika reaksi diatas merupakan reaksi orde satu. Kecepatan reaksi tergantung
hanya pada konsentrasi substrat tapi tidak pada nukleofiliknya. Hal ini mengherankan,
dimana substitusi nukleofilik atom karbon primer SN2 kecepatan reaksinya
tergantung pada konsentrasi substrat dan nukleofilik. Tetapi dengan adanya
partisipasi gugus tetangga mengakibatkan kecepatan reaksinya hanya bergantung
kepada konsentrasi substratnya saja.
PARTISIPASI GUGUS ORTO INTRAMOLEKUL
Dengan adanya dua substituent pada benzene dengan
posisi orto, dimana substituent pertama mengandung gugus pergi, dan substituen
kedua mengandung gugus yang berpartisipasi sebagai gugus tetangga, maka dapat
terbentuk senyawa intermediate melalui partisipasi gugus orto intramolekul.
1.Bagaimana reaksi SN2 cenderung mengalami inversi konfigurasi
?
2. Mengapa dalam hal ini kuat-lemahnya basa tidak
diperhitungkan ?
3. Mekanisme
reaksi SN1 dengan reaksi SN2.dimana letak perbedaan
reaksi tersebut?




saya akan mencoba menjawab pertanyaan yg pertama,
BalasHapusSubtitusi nukleofilik SN2:
Cermati bentuk umum mekanisme SN2:
Pada reaksi SN2 ”gugus pergi’’(gugus umum yang biasa adalah halida atau tosilat)diganti dengan suatu nukelofil.reaksi ini bekerja paling baik pada metil dan halida primer karena alkil halida yang mengandung banyak cabang dapat mengalami serangan nukelofil dari belakang.pada halida sekunder dan tersier reaksi SN2 sullit terjadi.
Perhtikan contoh ion hidroksida sebagai nukleofil dan bromine sebagai “gugus pergi” yang baik:
SN2 cendrung untuk mengalami inversi konfigurasi disebabkan serangan Nukleofil dari arah belakang.
disisni saya akan menjawab pertanyaan yang ketiga.
BalasHapusSubtitusi nukleofilik (SN1)
SN1 ditandai dengan reaksi yang melalui jalur karbokation.oleh karena itu,”gugus pergi” (leaving group) haruslah pada karbo ttersier atau skunder untk menstabilkan zat intermediante nya.dampak lain dari reaksi SN 1 memungkinkan terjadinya pergeseran hidrida dan metida.
Kekuatan basa:kuat – lemahnya basa tidak penting karena basa tidak terlibat dalam tahap penetuan laju reaksi alias tidak mempengruhi pembentukan karboktion.
Saya mencoba menjawab pertanyaan no 3 :
BalasHapusMekanisme reaksi SN1 cenderung mendominasi ketika atom karbon pusat dikelilingi oleh gugus-gugus yang meruab karena gugus-gugus tersebut menyebabkan rintangan sterik untuk terjadinya reaksi SN2. Selain itu, substituen yang meruab pada karbon pusat juga meningkatkan laju pembentukan karbokation oleh karena terjadinya pelepasan terikan sterik yang terjadi. Karbokation yang terbentuk juga distabilkan oleh stabilisasi induktif dan hiperkonjugasi yang berasal dari gugus alkil yang melekat pada karbon. Postulat Hammond-Leffler mensugestikan bahwa hal ini juga akan meningkatkan laju pembentukan karbokation. Oleh karena itu, mekanisme reaksi SN1 mendominasi pada reaksi di pusat alkil tersier dan juga terlihat pada reaksi di pusat alkil sekunder dengan keberadaan nukleofil lemah.
Berbeda dengan reaksi SN2, reaksi SN1 berjalan melalui dua tahap (tidak meliputi protonasi atau deprotonasi)